有關環境因素對耐腐蝕性影響的研究,主要是以304不銹鋼或316不銹鋼為對象來研究離子的種類、溫度的影響。日野(1958~1961年)研究了氯化物的種類、溫度、pH值、還有流動速度對18Cr-8Ni鋼發生點腐蝕的影響。在氯化物中,FeCl3和CuCl2能引起高度腐蝕;而且在40~80℃的溫度范圍內,溫度越高,點腐蝕發生的幾率越高;此外在pH值低的情況下會發生全面腐蝕,pH值是4~5時會發生點腐蝕,而pH值為7時點腐蝕的發生會減少。此外,在氯化鐵溶液中進行的有關流動速度影響的試驗表明,流動速度提高后,點腐蝕數量增多,點腐蝕面積減小,并漸漸轉為全面腐蝕。前川等(1965年)把304不銹鋼和304L不銹鋼置于25℃的1mol/dm3 H2SO4溶液中,然后在溶液中添加KCl,得出的陽極極化曲線表明隨著KCl濃度的升高,點腐蝕電位降低。藤井等(1970年)也闡明了耐點腐蝕能力隨著氯離子濃度、溫度的升高而下降這一點。
此后,關于氯化物水溶液中的溫度和氯離子影響這一點,Tru-man針對304不銹鋼所得出的數據表明,在高溫高濃度情況下發生應力腐蝕斷裂,溫度濃度下降后發生點腐蝕,若繼續下降則出現生銹現象。但藤井(1975年)對處于100℃以上的0.1mol/dm3NaCl溶液中的304、316、321不銹鋼進行了測定,根據這一測定結果可知:溫度越高,點腐蝕電位越低;在260℃的情況下,受氧化膜的影響,重新返回到高電位,耐點腐蝕性也得到恢復。而且還表明了NO3的添加使點腐蝕電位升高。丹野等(1988年)也測定了25~250℃的0.05~1 mol/dm3 NaCl溶液中的304不銹鋼的點腐蝕及縫隙腐蝕電位,從而證明了在25~175℃下這兩種電位都低,175℃以上點腐蝕電位升高,250℃時則出現全面腐蝕。
另一方面,除氯離子以外,對鹵離子和其他陰離子的研究也在積極地進行。森岡等(1964年)認為在鹵離子中,Br對18Cr8Ni鋼點腐蝕性的影響最大,其次是Cl-,I-,F-.鹽原(197年)分別使用25℃的0.5mol/dm3水溶液對304不銹鋼和316不銹鋼進行了試驗,以研究鹵離子對縫隙腐蝕的影響,進而證實了縫隙腐蝕電位依次是Cl-<Br-<I-(→高),這與Cl-,Br-對點腐蝕的影響存在異同點。
關于鹵離子之外的各種陰離子對含鹽水溶液中點腐蝕的影響,森岡等(1964年)證實了OH-、SO4-、NO3-有抑制點腐蝕的效果。而且也證明了添加少量的NO3-后,雖然會暫時出現點腐蝕,但只要進一步提高電位,點腐蝕就會再度停止。此外,鈴木等在1971年使用人工蝕孔研究了陰離子對抑制點腐蝕的影響,結果表明氧化性陰離子有抑制蝕孔內活性溶解的作用,按影響的大小順序排列依次為:NO3,NO2,MnO4,Cr2O/7,CrO24,ClO4。此外,藤井等(1972年)提出,能有效抑制點腐蝕產生的陰離子依次有NO3≥CrO4>WO24->H2PO2,能有效抑制點腐蝕發展的陰離子依次有NO3≥WO4->CrO4>H2PO2.另外根據鹽原(1961年)的研究報告,OH、SO4-、NO3使18Cr-8Ni鋼的電位升高(即有抑制作用),而對縫隙腐蝕電位幾乎沒有影響。中田等(1976年)也考察了SO24-的添加對SUS316L在氯化物溶液中的點腐蝕及縫隙腐蝕的影響,結果證明SO4-具有抑制腐蝕產生的效果,而沒有抑制活性成分偏析的作用。另外,中川等(1982年)在報告中稱,SO4-的添加能抑制:SUS304、316鋼縫隙腐蝕的產生與發展。還有沖等人(1984年)通過試驗得出,KClO3或K2Cr2O7的添加使304鋼在0.5mol/dm3 NaCl溶液中的點腐蝕得到抑制,而Fe2(SO4)3的添加反而加速縫隙腐蝕。
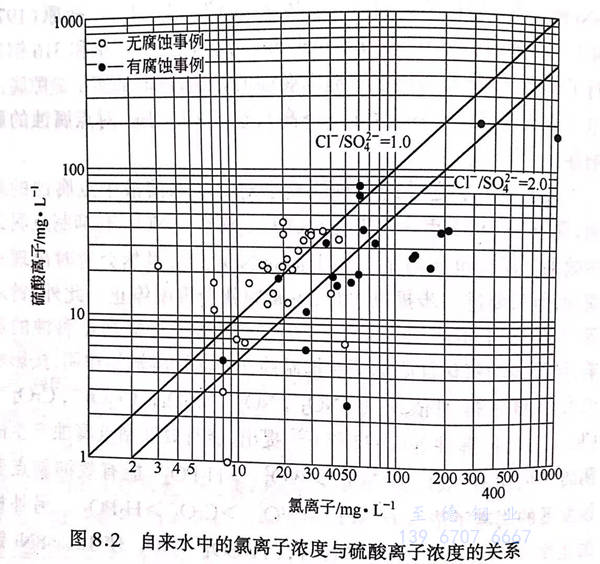
如上所述,多種陰離子都能抑制由氯離子引起的點腐蝕,但使用自來水的室內熱水供應管道經常在焊接接口處發生局部腐蝕,通過具體事例對這種局部腐蝕的發生與水質的關系進行了分析,結果得出Cl-和SO4-的影響如圖8.2(1998年)所示,這表明自來水中的Cl-與SO4的比值越大,越容易被腐蝕。
另外,關于采用陰極防點腐蝕這一點,北村等(1966年)通過試驗證明,利用外部電源法能防止2%NaCl+70%谷氨酸鈉溶液中的316L不銹鋼出現點腐蝕現象,這種方法同樣適用于化學工廠。為了防止在海水中使用的船舶和螺旋槳發生點腐蝕現象,藤井等(1968年)通過海水試驗證實了Zn作為動電陽極能防止304不銹鋼出現點腐蝕現象。保坂等(1976年)證實了鋅元素同樣能防止縫隙腐蝕的發生。



